Page Web archivée - Projet de Documentd'application de la réglementation RD-150Conception et mise en œuvre d'un programme d'essais biologiques
Cette page Web a été archivée dans le Web
L’information dont il est indiqué qu’elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n’est pas assujettie aux normes Web du gouvernement du Canada et elle n’a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
PRÉFACE
Le présent document d’application de la réglementation aide à concevoir et à mettre en œuvre un programme de surveillance relatif aux essais biologiques, conformément à la Loi sur la sûreté et la réglementation nucléaires (LSRN) et à ses règlements.
Le présent document présente les concepts fondamentaux permettant d’établir la nécessité d’un programme d’essais biologiques, de choisir les participants et de fixer la fréquence d’échantillonnage optimale. Il propose également des méthodes visant à interpréter les résultats.
Les principes et éléments clés de l’élaboration du présent guide sont conformes aux normes nationales et internationales, notamment le document 83-EHD-87, Bioassay Guideline 2—Guidelines for Tritium Bioassay, Report of the Working Group on Bioassay and in vivo Monitoring Criteria , de Santé et Bien-être Canada; le Human Respiratory Tract Model for Radiological Protection, de la Commission international de protection radiologique;et le Safety Guide RS-G-1.2, Assessment of Occupational Exposures Due to Intakes of Radionuclides, de l’Agence internationale de l’énergie atomique (AIEA).
Aucun élément contenu dans ce document ne doit être interprété par le titulaire de permis comme une autorisation de déroger aux exigences des règlements pertinents. Le titulaire de permis a la responsabilité d'identifier la législation, les conditions de permis, les lignes directrices ou les normes applicables et d'y adhérer.
TABLE DES MATIÈRES
1.0 OBJET
Le présent document d’application de la réglementation aide à concevoir et à mettre en oeuvre un programme de surveillance relatif aux essais biologiques, conformément à la Loi sur la sûreté et la réglementation nucléaires (LSRN, la Loi) et à ses règlements.
2.0 PORTÉE
Le document d’application de la réglementation présente les concepts fondamentaux permettant d’établir la nécessité d’un programme d’essais biologiques, de choisir les participants et de fixer la fréquence d’échantillonnage optimale. Il propose également les méthodes d’interprétation et d’enregistrement des résultats.
3.0 DISPOSITIONS LÉGISLATIVES APPLICABLES
Les dispositions législatives et règlements de la LSRN applicables au présent guide sont les suivants :
- L’article 27 de la LSRN, qui stipule que « Les titulaires de licence ou de permis et les personnes visées par règlement : a) tiennent les documents réglementaires, notamment un document sur la quantité de rayonnement reçue par chaque personne—ou la dose engagée à l’égard de chaque personne—dont les fonctions professionnelles sont liées aux activités autorisées par la présente loi ou qui se trouve dans un lieu où celles-ci sont exercées, les conserve durant la période réglementaire… »
- L’alinéa 3(1)e) du Règlement général sur la sûreté et la réglementation nucléaires, qui stipule que « La demande de permis comprend les renseignements suivants : …e) les mesures proposées pour assurer l’observation du Règlement sur la radioprotection… »
-
L’article 28 du
Règlement général sur la sûreté et la réglementation
nucléaires
, qui stipule que :
« (1) La personne qui est tenue de conserver un document aux termes de la Loi, de ses règlements ou d’un permis, le fait pour la période indiquée dans le règlement applicable ou, à défaut, pendant une année suivant l’expiration du permis qui autorise l’activité pour laquelle les documents sont conservés.
« (2) Il est interdit à quiconque d’aliéner un document mentionée dans la Loi, ses règlements ou un permis à moins : a) de ne plus être tenu de le conserver aux termes de la Loi, de ses règlements ou du permis; b) de donner à la Commission un préavis d’au moins 90 jours indiquant la date d’aliénation et la nature du document.
« (3) La personne qui avise la Commission conformément au paragraphe (2) dépose l’original ou une copie du document auprès d’elle sur demande » - L’alinéa 4a) du Règlement sur la radioprotection, qui stipule que « Le titulaire de permis met en œuvre un programme de radioprotection et, dans le cadre de ce programme : a) maintient le degré d’exposition aux produits de filiation du radon ainsi que la dose efficace et la dose équivalente qui sont reçues par la personne, et engagées à son égard, au niveau le plus bas qu’il soit raisonnablement possible d’atteindre, compte tenu des facteurs économiques et sociaux, par : … iii) le contrôle de l’exposition du personnel et du public au rayonnement, »…
- Le paragraphe 5(1) du Règlement sur la radioprotection, qui stipule que « Pour tenir le document sur les doses de rayonnement prévu à l’article 27 de la Loi, le titulaire de permis contrôle et enregistre l’ampleur de l’exposition aux produits de filiations du radon de chaque personne mentionnée à cet article, ainsi que la dose efficace et la dose équivalente qui sont reçues par la personne et engagées à son égard »,
- Le paragraphe 5(2) du Règlement sur la radioprotection, qui stipule que « Le titulaire de permis contrôle l’ampleur de l’exposition aux produits de filiation du radon, la dose efficace et la dose équivalente : a) par mesure directe résultant du contrôle; b) par évaluation, lorsque le temps et les ressources exigés pour une mesure directe sont trop importants par rapport à son utilité », et
- L’article 24 du Règlement sur la radioprotection, qui stipule que « Le titulaire de permis tient un document contenant les nom et catégorie d’emploi de chaque travailleur du secteur nucléaire. »
4.0 PARTICIPATION AUX ESSAIS
L’objectif d’un programme de surveillance est de déterminer quels sont les critères de participation au programme, la fréquence de la surveillance et les mesures à prendre en fonction des résultats des mesures.
Quatre types de programmes de surveillance sont décrits dans cette section. Ce sont la surveillance relative aux essais biologiques de référence, la surveillance relative aux essais biologiques courants, la surveillance relatives aux essais biologiques spéciaux, et les programmes de dépistage. Les sections 5.0 et 6.0 décrivent la fréquence de la surveillance et l’interprétation des résultats.
4.1 Essais biologiques de référence
La surveillance de référence consiste à évaluer, dès l’embauche, ou au moment de commencer des nouvelles tâches faisant l’objet d’une surveillance relative à des essais biologiques, la charge de radionucléides dans l’organisme d’un travailleur. Cette évaluation sert de référence pour le nouvel employé.
On doit effectuer un essai biologique de référence pour tous les travailleurs qui participent à un programme de surveillance relatif à des essais biologiques courants. Le type de mesure de référence devrait être pertinent et en rapport avec les radionucléides faisant l’objet d’une surveillance courante chez le travailleur. La surveillance de référence n’est pas requise pour l’air [1, 2].
4.2 Essais biologiques courants
Les doses associées à l’incorporation de radionucléides pour tous les travailleurs qui risquent de recevoir une dose efficace engagée (DEE) supérieure à 1 mSv par année. Lorsqu’il est peu probable que les travailleurs reçoivent des doses annuelles dépassant 1 mSv, le coût de la réalisation d’essais biologiques courants pourrait ne pas toujours être justifié pour les doses en question. Il est cependant possible d’envisager le recours à d’autres moyens, comme le dépistage, pour évaluer l’exposition.
La probabilité que la limite de 1 mSv par année soit dépassée peut être évaluée en fonction de l’activité manipulée par le travailleur, le type de radionucléides en cause, la forme physique et chimique des radionucléides, le type de confinement utilisé et la nature des opérations effectuées. Lorsqu’un type de radionucléide est manipulé pratiquement chaque jour (c’est-à-dire environ 250 jours par année), les travailleurs qui manipulent des radionucléides dont l’activité figure au tableau 1 doivent participer à un programme d’essai biologique. Il convient de noter que, pour décider de la participation du travailleur au programme, les données de surveillance (si elles sont disponibles) doivent remplacer les données du tableau 1.
Les fondements sur lesquels reposent les valeurs présentées au tableau 1 sont expliqués dans l’annexe A, Choix des participants à un programme d’essais biologiques courants basé sur l’activité manipulée , et l’on peut s’en servir pour dériver des valeurs propres au site. L’annexe A définit les paramètres requis pour définir la fraction d’incorporation potentielle (FIP). Pour un scénario d’incorporation particulier, la valeur LAI / FIP représente l’activité manipulée par jour de travail qui pourrait donner lieu à une incorporation annuelle égale à la limite annuelle d’incorporation (LAI), et, par conséquent, à une dose efficace engagée de 20 mSv par année. Le critère fixé pour la participation à un essai biologique est de 1 mSv. Par conséquent, les données figurant au tableau 1 représentent la quantité LAI / (20 * FIP).
Tableau 1 : Activité manipulée quotidiennement sur une période d’un an,
au-delà de laquelle un essai biologique est recommandé
|
Volatilité |
||
|
Confinement |
Gaz, liquides volatils et poudres |
Liquides non volatils et matières solides |
|
Aucun |
≥ 2 * LAI |
≥ 200 * LAI |
|
Hotte |
≥ 200 * LAI |
≥ 20 000 * LAI |
|
Boîte à gants |
≥ 20 000 * LAI |
≥ 2 000 000 * LAI |
|
Pseudo-scellé |
≥ 50 * LAI |
≥ 10 000 * LAI |
Il est recommandé que les travailleurs qui doivent porter un équipement de protection respiratoire spécifiquement pour limiter l’incorporation de radionucléides fassent l’objet d’un essai biologique.
Les « pseudo » sources scellées[3] s’appliquent aux radionucléides à courte période (inférieure à sept (7) jours) qui sont manipulés exclusivement dans des flacons scellés et des seringues, et qui respectent les conditions suivantes :
- la période radiologique est inférieure à 7 jours;
- la manutention de la radioactivité est plus ou moins uniforme durant l’année;
- la matière radioactive n’est pas mise à l’état d’aérosol, ni portée à ébullition dans un contenant ouvert ou comportant des ouvertures;
- la matière radioactive se présente sous la forme d’une solution diluée;
- la matière radioactive est contenue dans un flacon multi-doses qui n’est jamais ouvert, et dont les quantités prédosées sont retirées uniquement au moyen de seringues en vue de l’injection immédiate dans un autre flacon multi-doses, ou dans un autre type de contenant fermé, ou administrée aux patients.
Les données du tableau 1 sont générales et n’englobent pas tous les scénarios. On suppose également qu’il y a d’autres barrières mécaniques ou d’autres barrières physiques en place pour protéger le travailleur (comme des boîtes à gants et des hottes), les barrières étant propres à chaque radioisotope manipulé, utilisées convenablement et entretenues de manière appropriée.
Lorsque plus d’un type de radionucléides sont manipulés, les étapes suivantes doivent être respectées afin de déterminer si le travailleur doit participer à un programme d’essais biologiques :
- Calculer le rapport, rj, de la quantité d’un radionucléide, j, manipulé quotidiennement, à la quantité maximale de ce radionucléide pouvant être manipulée quotidiennement et au-delà de laquelle un essai biologique est recommandé, selon le tableau 1.
- Calculer ce rapport pour tous les autres radionucléides manipulés.
-
Additionner tous les rapports calculés aux étapes 1 et 2 :
R = Σ rj
Un essai biologique doit être réalisé pour tous les radionucléides dont le rj ≥ 1; si R ≥ 1, un essai biologique doit être réalisé pour tous les radionucléides pour lesquels le rj ≥ 0,3 [4]. Un exemple de ce calcul figure à l’annexe B, Exemples, Exemple 1.
4.3 Essais biologiques spéciaux
Les essais biologiques spéciaux sont réalisés pour vérifier des signes d’une incorporation importante non prévue, ou pour évaluer la dose reçue par un travailleur résultant d’une telle incorporation. La surveillance relative aux essais biologiques spéciaux peut être déclenchée soit par un résultat de surveillance courante ou par un incident anormal laissant présumer qu’un seuil d’intervention (tel que défini dans le Règlement sur la radioprotection) ou que la limite de dose pourraient avoir été dépassés. Une orientation sur la surveillance relative aux essais biologiques spéciaux est fournie dans le document d’application de la réglementation G-147, Protocoles d’intervention pour les essais biologiques en cas d’incorporation anormale de radionucléides [5].
4.4 Programme de dépistage
Lorsque les travailleurs manipulent des radionucléides non scellés, mais qu’ils ne respectent pas les critères de participation à un programme d’essais biologiques courants, il est recommandé que les incorporations soient surveillées dans le cadre d’un programme de dépistage. La fréquence du dépistage peut être la même que celle de la surveillance courante, ou elle peut être différente si la manutention de radionucléides non scellés est occasionnelle (par exemple on peut effectuer le dépistage quelques jours après la manutention), compte tenu de la période biologique des radionucléides en cause.
Dans le programme de dépistage, les travailleurs doivent soit se soumettre à un comptage in vivo, ou fournir un échantillon d’essai biologique in vitro (voir section 5.1). Les résultats sont comparés à une valeur seuil, comme l’activité dérivée (AD, décrite à la section 6.2), sans qu’il soit nécessaire d’effectuer une évaluation de la dose ou une estimation de l’incorporation. Le dépassement de la valeur seuil prédéterminé nécessite une confirmation de l’incorporation et une enquête.
Lorsqu’un travailleur dépasse fréquemment la valeur seuil, il convient de réévaluer la participation de celui-ci à un programme d’essais biologiques courants. Tous les résultats du dépistage doivent être enregistrés.
5.0 MÉTHODE ET FRÉQUENCE DES ESSAIS BIOLOGIQUES
Il existe différentes méthodes d’échantillonnage pouvant être utilisées dans le cadre des essais biologiques (par exemple, l’analyse d’urine, le comptage du corps entier, le comptage thyroïdien), selon le type de matière radioactive manipulée et la fréquence de surveillance des travailleurs.
5.1 Méthodes d’essais biologiques
Les mesures effectuées dans le cadre des essais biologiques sont regroupées en deux catégories distinctes :
- les mesures d’essais biologiques in vivo : ce sont les mesures directes de la quantité de matières radioactives déposée dans les organes, les tissus ou le corps entier. Les méthodes courantes comprennent le comptage thyroïdien, le comptage pulmonaire et le comptage du corps entier.
- les mesures d’essais biologiques in vitro : ce sont les mesures de la quantité de matières radioactives contenues dans un échantillon provenant du corps humain. La méthode la plus courante est l’analyse d’urine. Il existe également d’autres méthodes, comme l’analyse des fèces, de l’haleine et du sang.
Plusieurs facteurs sont à considérer au moment de choisir la méthode de surveillance relative aux essais biologiques. Le premier facteur est l’objectif de la surveillance—il doit y avoir un équilibre entre les besoins liés à la surveillance de l’incorporation et l’évaluation de la dose [2]. La surveillance de l’incorporation exige des renseignements opportuns concernant les événements d’incorporation, et doit être basée sur les indicateurs d’incorporation suivants, par ordre de préférence :
- l’utilisation d’un échantillonneur d’air personnel (EAP), où un échantillon d’air est prélevé dans l’espace d’air respirable du travailleur;
- les essais biologiques in vitro;
- les essais biologiques in vivo.
Les méthodes d’essais biologiques qui doivent être utilisées aux fins de l’évaluation de la dose sont, par ordre de préférence :
- les essais biologiques in vivo;
- les essais biologiques in vitro;
- l’utilisation d’un échantillonneur d’air personnel.
En plus de ces facteurs, les caractéristiques physiques des radionucléides qui nous intéressent devraient être prises en compte. Certains radionucléides émettent un rayonnement ne pouvant être détecté depuis l’extérieur du corps. Dans ce cas, on peut mesurer un produit de désintégration, comme le 234Th, au moment d’évaluer la charge pulmonaire de 238U. Ou encore, des essais biologiques in vitro peuvent être effectués. La méthode de mesure in vitro à privilégier dépend également de la rétention et de l’excrétion du radionucléide en question, y compris les voies prédominantes d’excrétion, par exemple la voie urinaire, les fèces et l’haleine.
Le tableau 2 montre différentes méthodes d’essais biologiques pouvant être effectuées pour divers radionucléides, compte tenu des caractéristiques physiques et métaboliques.
Remarque : Dans les cas où les essais biologiques ne permettent pas de déterminer la dose, on peut utiliser des données de surveillance de l’air pour estimer la dose. Voir section 5.2.
Tableau 2 : Méthodes d’essais biologiques pour divers radionucléides
|
Méthodes d’essais biologiques |
Radionucléide |
|||
|
1) In vivo |
||||
Comptage du corps entier |
11C
|
95Zr/95Nb
|
144Ce
|
|
Comptage pulmonaire |
14C*
|
239Pu, 240Pu
|
242Cm, 244Cm
|
|
Comptage thyroïdien |
125I, 131I |
|||
|
2) In vitro |
||||
|
Comptage à scintillateur liquide (comptage β) des échantillons d’urine |
3H
|
35S
|
45Ca
|
|
|
Comptage à scintillateur liquide des échantillons d’urine après séparation chimique |
14C |
89Sr ,90Sr |
228Ra |
|
|
Comptage β du CO2 de l’haleine |
14C |
|||
|
Comptage β des échantillons fécaux après séparation chimique |
14C |
|||
Comptage β de l’eau tritiée dans l’haleine |
3H |
|||
Spectroscopie gamma des échantillons d’urine |
57Co, 58Co, 60Co |
85Sr
|
125I, 131I
|
|
|
Spectroscopie gamma des échantillons fécaux après séparation chimique |
60Co |
144Ce |
||
|
Spectroscopie alpha des échantillons d’urine/de fèces après séparation radiochimique |
226Ra
|
238Pu, 239Pu, |
241Am
|
|
Fluorimétrie, phosphorimétrie |
Uranium |
|||
ICP-MS |
234U, 235U, 238U |
238Pu, 239Pu |
||
SMIT |
238Pu, 239Pu |
|||
* À l’aide d’un compteur de particules de type « phoswich ».
5.2 Détermination de la fréquence
Au moment de choisir la fréquence d’une surveillance de routine, les principaux facteurs à prendre en compte sont les suivants :
- les caractéristiques du lieu de travail;
- l’incertitude liée au moment de l’incorporation;
- la sensibilité des instruments;
- la nécessité d’obtenir de l’information opportune sur les événements d’incorporation;
- le coût de la mise en œuvre du programme de surveillance.
La forme physique et chimique de chaque radionucléide utilisé sur les lieux de travail doit être connue à la fois pour les conditions courantes et les conditions d’accident. Ces formes déterminent le comportement biocinétique de chaque radionucléide et, par conséquent, les voies et les taux d’excrétion. En retour, ce comportement aide à déterminer la méthode d’essai biologique à employer.
La rétention et l’excrétion dépendent principalement de la forme chimique du radionucléide. Les composés inhalés sont classés dans trois catégories, selon le taux d’absorption entre les poumons et le sang : F (de l’anglais Fast), M (de l’anglais Moderate) et S (de l’anglais Slow). Par exemple, un composé de type F, comme le UF6 est absorbé relativement rapidement dans le sang en provenance des poumons. Les composés de type S, comme le UO2, subsistent dans les poumons pendant une période de temps plus longue. Les valeurs des taux d’absorption par défaut sont précisées dans la publication 66 de la CIPR (Commission internationale de protection radiologique), intitulée : Human Respiratory Tract Model for Radiological Protection, vol. 24, nos 1 à 3 [6] pour les trois types de clairance pulmonaire et pour les critères servant à la classification selon le type d’absorption, lorsque l’on utilise des données spécifiques pour caractériser l’air des lieux de travail.
Un autre facteur dont il faut tenir compte dans le choix de la fréquence de surveillance est l’incertitude liée à l’estimation de l’incorporation, en raison du fait que le moment de l’incorporation n’est pas connu (voir annexe B, Exemples, figures B3 et B4). En ce qui a trait à la surveillance hebdomadaire, il y a une incertitude importante associée au moment de l’incorporation dans le cas de l’excrétion urinaire (voir annexe B, figure B4), à cause des grands écarts dans le taux d’excrétion au cours des premiers jours suivant l’incorporation. Les résultats des mesures courantes doivent être évalués de manière à ce que l’incorporation soit considérée comme s’étant produite à mi-temps de la période de surveillance.
La sensibilité de l’instrument a une incidence importante sur la fréquence de la surveillance. Celle-ci doit être choisie de manière à s’assurer que les doses importantes ne sont pas manquées. Une dose peut être oubliée dans les cas où, suite à une incorporation, la concentration dans le corps représentée par le taux d’excrétion a été réduit à un niveau inférieur à la quantité minimale détectable (QMD) de l’instrument durant le temps qui s’écoule entre l’incorporation et la mesure. Lorsque cela est possible, la période de surveillance devrait être telle que les incorporations annuelles correspondant à une dose engagée totale de 1 mSv soient détectées. Si cela n’est pas réalisable, on doit avoir recours à la surveillance sur les lieux de travail et à l’échantillonnage de l’air personnel pour compléter la surveillance de l’incorporation. En appliquant le modèle métabolique approprié et en supposant un modèle d’incorporation, la période de surveillance adéquate peut être déterminée.
L’activité dérivée (AD) peut être définie comme suit :
![]()
où :
|
T |
= |
la période de surveillance |
|
m( |
= |
la fraction de l’incorporation qui est retenue dans un tissu, un organe ou le corps entier, ou qui est excrétée par le corps, à mi-temps de la période de surveillance (voir annexe B, Exemples, figures B1 à B4) |
Les valeurs de m(![]() ) peuvent être consultées dans la publication 78 de la CIPR
(Commission internationale de protection radiologique), intitulée :
Individual Monitoring for Internal Exposure of Workers, Replacement of ICRP Publication 54 [7],
portant sur la surveillance des incorporations de radionucléides.
) peuvent être consultées dans la publication 78 de la CIPR
(Commission internationale de protection radiologique), intitulée :
Individual Monitoring for Internal Exposure of Workers, Replacement of ICRP Publication 54 [7],
portant sur la surveillance des incorporations de radionucléides.
La période maximale recommandée est celle où l’AD est égale à la QMD. La limite de détection (c’est-à-dire la QMD, ou quantité minimale détectable) [8] peut être définie comme suit :
QMD = (![]() )(2,71 + 4,65σb)
)(2,71 + 4,65σb)
où :
|
K |
= |
un facteur d’étalonnage (K dépend du radionucléide et de l’efficacité de la détection) |
|
t |
= |
le temps de comptage de la procédure |
|
σb |
= |
l’écart-type du nombre de coups obtenu pour le personnel non contaminé |
Dans le cas des essais biologiques in vitro :
K = E V Y e-λΔt
où :
|
E |
= |
l’efficacité du comptage |
|
V |
= |
la taille de l’échantillon en unités de masse ou de volume |
|
Y |
= |
la fraction chimique, s’il y a lieu |
|
λ |
= |
la constance de désintégration radioactive du radionucléide |
|
Δt |
= |
le temps écoulé entre le prélèvement de l’échantillon et le comptage |
Dans le cas des essais biologiques in vivo, K est l’efficacité du comptage, y compris une correction pour l’auto-absorption, s’il y a lieu.
De façon générale, K doit être déterminé par le personnel qui effectue les mesures de l’essai biologique. On peut obtenir de plus amples renseignements sur les QMD dans l’American National Standard–Performance Criteria for Radiobioassay, Health Physics Society [8].
À l’aide de cette méthode servant à déterminer la période de surveillance, une période de surveillance recommandée d’un an serait peut-être possible pour certains radionucléides. Cependant, les taux de rétention et d’excrétion chez la plupart des personnes varient par rapport au modèle sur lequel les AD sont basées. En outre, de l’information opportune concernant les événements d’incorporation est requise. Il doit y avoir un équilibre entre l’utilisation des essais biologiques à titre d’indicateurs de l’incorporation et aux fins de l’évaluation de la dose. Pour tenir compte de cette situation, on pourrait choisir d’utiliser une période de surveillance plus courte qu’un an, selon les autres types de surveillance en place (comme la surveillance de l’air sur les lieux de travail), et selon le côté pratique de la réalisation des mesures d’essais biologiques. Des périodes de surveillance ont été recommandées dans les rapports portant sur des radionucléides spécifiques (comme l’évaluation de la dose imputable à l’uranium [9]).
5.3 Autres considérations dosimétriques
En plus de la recommandation à l’effet que des incorporations de 1/20 LAI soient détectables pendant la durée de la période de surveillance, d’autres considérations dosimétriques peuvent être utilisées pour aider à déterminer la fréquence des essais biologiques.
La CIPR recommande que la précision des mesures soit supérieure à un facteur de 2 [7] pour l’intervalle de confiance de 95 %, dans le cas des doses reçues en provenance de sources d’exposition externes, mais en ce qui a trait aux expositions internes, ce niveau de précision n’est pas toujours possible. Les incertitudes dues au fait que le moment de l’incorporation n’est pas connu n’est qu’une des composantes de l’incertitude globale associée au calcul de la dose. Les périodes de surveillance recommandées dans la publication 78 de la CIPR, intitulée : Individual Monitoring for Internal Exposure of Workers, Replacement of ICRP Publication 54, Commission internationale de protection radiologique, Publication 78 [7], accepte un facteur de 3 pour ce qui est de l’incertitude due au fait que le moment de l’exposition n’est pas connu pendant la période de surveillance. S’il y a plusieurs périodes de surveillance durant l’année, l’incertitude globale associée à l’incorporation annuelle, ainsi que la dose engagée seront probablement inférieures à ce facteur de 3 [10]. L’exposition à certaines sources internes, comme les faibles concentrations d’eau tritiée dans certains milieux de réacteurs CANDU, peut se produire de façon contenue pendant la période de surveillance.
Dans certains cas, les meilleures méthodes de surveillance disponibles ne permettent pas de détecter de manière fiable des activités correspondant à 1/20 LAI (1 mSv par année). Dans ces circonstances, il est pratique de déterminer la dose maximale qui pourrait être manquée si l’incorporation se produit au début de chaque période de surveillance. Une telle méthode fournit une perspective utile pour certains dangers internes complexes [11], mais parfois être trop prudente, particulièrement lorsqu’on dénombre plusieurs périodes de surveillance par année.
6.0 INTERPRÉTATION DES RÉSULTATS
6.1 Niveaux de référence
Des niveaux de reference sont les valeurs de quantités mesurées telles que s’ils sont dépassées, des actions spécifiées ou des décisions devraient être prises.
Des niveaux de référence peuvent être utilisés pour interpréter les données de surveillance sur les lieux de travail ou les données de surveillance associées aux essais biologiques et pour signaler les incorporations potentielles. Ces niveaux, qui sont applicables aux programmes courants ou spéciaux de surveillance relatifs aux essais biologiques, permettent une réponse progressive aux incorporations potentielles et, par conséquent, ne constituent pas une limite réglementaire en soi. Les niveaux de référence sont habituellement exprimés sous la forme de fractions de la LAI. La somme des ratios (incorporation par rapport à la LAI) devrait être utilisée lorsque plus d’un radionucléides sont en cause.
Étant donné que les programmes de surveillance relatifs aux essais biologiques permettent rarement de mesurer l’incorporation, les niveaux de référence dérivés–exprimés en termes de quantité mesurée–sont généralement une quantité plus utile. Le niveau de référence dérivé est l’activité déterminée par l’essai biologique, attribuable aux sources en milieu de travail. Le niveaux de référence dérivé pour une mesure d’essai biologique en particulier, est exprimée dans les mêmes unités que les résultats de mesure de l’essai biologique. Dans le cas des programmes d’essais biologiques courants, les niveaux de référence doivent être basés sur l’hypothèse d’une incorporation à mi-temps de la période de surveillance.
Pour certains radionucléides et certains types d’essais biologiques, les sources « non professionnelles » (comme l’uranium et le césium) peuvent faire en sorte que les résultats courants dépassent le niveau de la décision analytique et un niveau de référence dérivé. Si les résultats de l’essai biologique dépassent régulièrement ou souvent un niveau de référence dérivé due à des sources non professionnelles, le niveau de référence dérivé peut être augmenté si les résultats prévus de l’essai biologique, dus à de telles sources, sont connus (une étude utilisant un groupe témoin ayant reçu une exposition non professionnelle semblable, mais sans risque d’exposition professsionnelle, peut être utilisée à cette fin). Le niveau de référence dérivé et ajusté est fixé à une valeur ne dépassant pas le 99e percentile du groupe témoin [2]. Si les niveaux non professionnels dépassent le niveau d’enquête dérivé (NED), d’autres méthodes de surveillance de l’incorporation doivent être utilisées si possible.
Les niveaux de référence utilisés dans ce rapport sont l’AD, le niveau d’enquête (NE), et le niveau d’enquête dérivé (NED). L’AD est définie à la section 5.2. Le NE et le NED sont définis ci-après.
NE = (0,3 LAI)
![]()
![]()
où :
|
T |
= |
la période de surveillance, en jours |
|
m( |
= |
la fraction de l’incorporation qui est retenue dans un tissu, un organe, ou le corps entier, ou qui est excrétée du corps, à mi-temps de la période de surveillance |
Un tableau illustrant des exemples de NED pour l’inhalation de composés de 137Cs de type F figure à l’annexe B, Exemples, tableau B2.
Afin de tenir compte de la limite de dose réduite reçue par les travailleuses enceintes, on doit fixer un NED pour celles-ci. Étant donné que la limite de dose pour la travailleuse enceinte est de 4 mSv pour le reste de la grossesse, il faut s’assurer que la dose reçue par la travailleuse enceinte est < 0,5 mSv par mois, pour veiller à ce que la limite de 4 mSv ne soit pas dépassée. Par conséquent, un NED pour les travailleuses enceintes, le NEDTE, peut être défini comme suit :
![]()
6.2 Mise en perspective des résultats des essais biologiques
Les résultats des essais biologiques peuvent être interprétés en les comparant avec les niveaux de référence dérivés. Le tableau 3 fournit les niveaux de référence proposés qui peuvent servir de fondement à l’interprétation des résultats d’essais biologiques et dicter les mesures appropriées à prendre.
Tableau 3 : Niveaux de référence dérivés et mesures correspondantes recommandées
|
Résultat d’essai biologique |
Mesure recommandée |
< AD |
Enregistrer le résultat de la mesure de l’essai biologique. |
AD ≤ résultat < NE |
Confirmer et enregistrer le résultat de la mesure de l’essai biologique. Si le résultat est confirmé, évaluer la DEE. |
≥ NE |
Confirmer et enregistrer le résultat de la mesure de l’essai biologique. Si le résultat est confirmé, évaluer la DEE. Enquêter pour trouver et corriger la cause de l’incorporation. |
Pour évaluer la DEE, les résultats de l’essai biologique doivent d’abord être combinés avec m(T/2) pour estimer l’incorporation :

La DEE peut être estimée à l’aide de la formule suivante :
DEE = Incorporation × e(50)
où e(50) est la dose par incorporation unitaire de radionucléide, taille de particules et forme chimique [12].
6.3 Précision des résultats d’essais biologiques
De nombreux composants contribuent à la précision globale de l’estimation de la dose. Ceux-ci comprennent la précision :
- du système de détection;
- de la méthode de mesure;
- du modèle biologique utilisé pour établir un lien entre la radioactivité interne observable et la dose de rayonnement reçue;
- l’incertitude du temps réel d’internalisation de la radioactivité par rapport au moment de la mesure de l’essai biologique.
La présente section ne porte que sur la précision des composants 1 et 2. Tous les aspects de l’incertitude du modèle biologique, qui peuvent parfois être la source prédominante des inexactitudes et des incertitudes dans l’estimation de la dose finale, sont détaillés dans le document Reliability of the ICRP’s Systemic Biokinetic Models, Radiation Protection Dosimetry, Vol. 79, R.W. Leggett [13]. Les incertitudes associées au moment de l’incorporation pour ce qui est du moment auquel la surveillance est effectuée sont examinées brièvement à la section 5.2.
Lors de la conception et de l’établissement d’un programme de surveillance relatif aux essais biologiques, il est important de tenir compte de la précision des instruments en rapport avec la mesure à prendre. Le système complet de mesure devrait être tel que toute erreur dans la mesure finale n’aura qu’une incidence mineure sur la précision globale de la dose de rayonnement estimée reçue par le travailleur. Comme d’autres incertitudes sont importantes (par exemple les points 3 et 4), on estime qu’une plage de –25 % à +50 % [14] soit retenue pour la composante « instrument de détection » des incertitudes.
Les considérations suivantes doivent être incluses dans l’évaluation de la précision des instruments et de la méthode de mesure :
-
L’erreur de comptage statistique nette.
Cela comprend l’erreur statistique dans le comptage de l’essai biologique et l’erreur statistique dans la mesure du taux de comptage du rayonnement de fond. Le taux de comptage du rayonnement de fond doit être approprié à la norme, à l’échantillon ou au sujet.
-
L’erreur causée par des variations dans la géométrie de comptage.
Cela doit comprendre les tolérances relatives aux écarts physiques chez les sujets ou dans les échantillons ayant fait l’objet d’un comptage, particulièrement en ce qui a trait à l’équipement de comptage spécifique utilisé.
-
L’erreur introduite par l’atténuation du rayonnement émis par les tissus sus-jacents
durant le comptage in vivo.
L’effet des tissus sus-jacents doit être considéré lorsque l’émission gamma du nucléide en question est inférieure à 200 keV [15], ou lorsque le rayonnement de freinage (Bremsstrahlung) associé aux émissions bêta sont comptés. Il faut donc estimer la profondeur et la densité moyennes des tissus sus-jacents, qui peuvent varier considérablement d’une personne à une autre.
-
L’étalonnage de l’instrument en fonction de l’isotope mesuré dans une
géométrie pertinente pour la mesure réelle.
L’instrument employé pour l’essai biologique devrait être étalonné en fonction de l’isotope qui présente de l’intérêt et un programme de contrôle de la qualité régulier devrait être en place, afin de s’assurer que l’étalonnage est régulièrement effectué. Des vérifications internes fréquentes à l’aide d’une source radioactive à longue période doivent également être effectuées sur une base régulière, pour confirmer que la réponse du détecteur est constante au fil du temps et qu’il fonctionne correctement.
L’exemple 2 de l’annexe B, Exemples, contient un exemple de calcul de l’erreur de comptage pour un résultat d’essai biologique.
7.0 ENREGISTREMENT DES RÉSULTATS D’ESSAIS BIOLOGIQUES
Un registre d’essais biologiques permet de retracer les données de dose en vue de reconstituer éventuellement la dose.
Afin de se conformer à la Section 27 de la LSRN, la Section 28 du Règlement général sur la sûreté et la réglementation nucléaires et la sous-section 5(1) ainsi que la Section 24 du Règlement sur la radioprotection, un registre d’essais biologiques doit être tenu pour chaque personne qui participe au programme d’essais biologiques. De plus, ce registre doit clairement identifier l’employé par le nom d’employé ainsi que son groupe de travaille. Plus de renseignements pourraient être exigés afin de se conformer avec une condition de permis. Pour chaque période de dosimétrie, les données relatives aux essais biologiques doivent être conservées, ainsi que la date à laquelle la mesure a été prise. Les registres doivent également comprendre un contrôle de la qualité des instruments, les résultats de l’étalonnage et les registres de traçabilité avec des laboratoires primaires et secondaires.
Les exigences relatives à la rétention de registres se trouvent sur le permis ou à l’article 28 du Règlement général sur la sûreté et la réglementation nucléaires .
GLOSSAIRE
Activité dérivée (AD)
La rétention ou le taux d’excrétion, exprimé soit en Bq ou en Bq/jour, résultant d’une mesure unique d’un radionucléide, obtenue à la fin d’une période de surveillance qui est tel que la dose efficace engagée annuelle correspondante extrapolée est égale à 1 mSv. L’AD est calculée en supposant que l’incorporation ait eu lieue au point milieu de la période de surveillance.
Bremsstrahlung
Rayonnement électromagnétique produit par la décélération d’une particule chargée, comme un électron, lorsque celle-ci est déviée (changement de moment) par une autre particule chargée, comme le noyau d’un atome.
Dose absorbée (D)
L’énergie absorbée lors d’une exposition au rayonnement par masse unitaire. L’unité SI de la dose absorbée est le gray (Gy).
Dose efficace (E)
Somme, exprimée en sieverts, des valeurs dont chacune représente le produit de la dose équivalente reçue par un organe ou un tissu, et engagée à leur égard, figurant à la colonne 1 de l’annexe 1 (Règlement sur la radioprotection) par le facteur de pondération du tissu figurant à la colonne 2 (Règlement sur la radioprotection).
Dose efficace engagée (DEE) (E(50))
La dose efficace résultant de l’incorporation d’une substance radioactive. Cette dose est accumulée sur une période de 50 ans suivant l’incorporation initiale. L’unité SI de la DEE est le sievert (Sv).
Dose équivalente (HT)
Produit, exprimé en sieverts, de la dose absorbée d’un type de rayonnement figurant à la colonne 1 de l’annexe 2 (Règlement sur la radioprotection) par le facteur de pondération du rayonnement figurant à la colonne 2 (Règlement sur la radioprotection).
Échantillonneur d’air personnel (EAP)
L’échantillonneur d’air personnel comprend un porte-filtre et une pompe à vide à piles, et est porté par le travailleur dans le but d’estimer les concentrations de radionucléides dans l’air respirable qui l’entoure. Les échantillonneurs d’air personnel portent également le nom de micro-échantillonneurs.
Essai biologique
Mesure de la quantité ou de la concentration d’un radionucléide dans le corps ou dans une matière biologique excrétée ou retirée du corps et analysée aux fins de l’estimation de la quantité de radionucléide dans le corps.
Essai biologique in vitro
Mesures visant à détecter la présence de matières radioactives, ou à en estimer la quantité dans les fèces ou dans d’autres matières biologiques excrétées ou retirées du corps.
Essai biologique in vivo
Mesures d’une matière radioactive présente dans le corps à l’aide d’instruments qui détectent le rayonnement émis par cette matière, à l’intérieur du corps.
Facteur de pondération des tissus
Facteur pour lequel la dose équivalente est pondérée aux fins de la détermination de la dose efficace. Le facteur de pondération des tissus pour un organe ou un tissu représente la contribution relative de cet organe ou de ce tissu au préjudice total causé par les effets de l’irradiation uniforme du corps entier [16].
Facteur de pondération du rayonnement
Facteur pour lequel la dose absorbée est pondérée dans le but de déterminer la dose équivalente. Le facteur de pondération du rayonnement pour un type spécifique et une énergie de rayonnement a été choisi de manière à être représentatif des valeurs de l’efficacité biologique relative (EBR) de ce rayonnement en induisant des effets stochastiques à de faibles doses. L’EBR d’un rayonnement, comparativement à un autre, est le rapport inverse des doses absorbées produisant le même degré d’un point final biologique défini [16].
Fonction d’excrétion (m)
Expression mathématique de la fraction d’excrétion d’un radionucléide hors du corps à n’importe quel moment suite à l’incorporation, généralement exprimée en becquerels excrétés par jour, par becquerel incorporé.
Fraction d’incorporation potentielle (FIP)
Quantité sans dimension qui définit l’incorporation comme étant une fraction de l’exposition à la contamination. La fraction d’incorporation dépend de plusieurs facteurs : rejet, confinement, dispersabilité, facteur d’occupation. Par exemple, FIP=0 dans le cas des matières encapsulées, étant donné qu’aucune particule radioactive ne peut pénétrer dans le corps d’un travailleur.
Incorporation
Quantité d’un radionucléide auquel le corps a été exposé par inhalation, absorption cutanée, injection, ingestion, ou par le biais de blessures.
Limite annuelle d’incorporation (LAI)
L’activité d’un radionucléide qui, lorsqu’il est incorporé, résulte en une DEE de 20 mSv.
Limite dérivée de concentration dans l’air (LDCA)
Concentration d’un radionucléide dans l’air qui, lorsqu’il est inhalé à un rythme respiratoire de 1,2 m3 par heure, pendant 2 000 heures dans une année, résulte en une incorporation de 1 LAI.
Modèle de biocinétique
Description mathématique du comportement des radionucléides dans les réactions métaboliques qui se produisent dans les cellules, les tissus, les organes et les organismes. On utilise surtout ce modèle pour décrire la répartition des radionucléides dans les tissus et leur excrétion.
Niveau de décision analytique (niveau critique)
Mesure du nombre de coups enregistrés par un instrument, ou mesure finale de l’instrument effectuée pour détecter une quantité d’un mélange à analyser, pour laquelle ou au-delà de laquelle une décision est prise à l’effet qu’une quantité positive du mélange à analyser est présente.
Niveau d’enquête (NE)
Indicateur de l’incorporation (en Bq) de substances radioactives qui nécessite une surveillance spéciale du travailleur. Cet indicateur est habituellement exprimé comme étant une fraction de la LAI.
Niveau d’enquête dérivé (NED)
Lorsqu’un programme de surveillance de la contamination interne est en place, il convient de déterminer, à l’avance, les niveaux de contamination au-delà desquels certaines mesures sont requises. Le niveau d’enquête dérivé (NED) est le niveau auquel une enquête ou une évaluation de la dose est initiée.
Niveau de référence dérivé
Activité déterminée par l’essai biologique, attribuable aux sources en milieu de travail.
Période biologique
Temps nécessaire pour que la moitié de la masse de radionucléides donnés présente dans l’organisme soit évacuée par les voies naturelles (autres que la désintégration radioactive).
Quantité minimale détectable (QMD)
Quantité la plus faible (activité ou masse) d’un radionucléide (ou d’un mélange à analyser) dans un échantillon, qui sera détectée avec une probabilité ß de non-détection (erreur de type II), tout en ayant une probabilité α de conclure fautivement qu’une quantité du mélange à analyser positive (différente de zéro) du mélange à analyser est présente dans un « échantillon à blanc » approprié (erreur de type I).
Sievert (Sv)
Unité de dose équivalente, de dose efficace et de DEE. Un sievert est défini comme étant un joule d’énergie absorbée par kilogramme de tissu, multiplié par un facteur de pondération approprié, sans dimension. Voir également « dose équivalente » et « dose efficace ».
RÉFÉRENCES
- U.S. Department of Energy, DOE Standard Internal Dosimetry, DOE-STD-1121-98, 1999.
- Health Physics Society, American National Standard-Design of Internal Dosimetry Programs, ANSI/HPS N13.39-2001.
- Commission canadienne de sûreté nucléaire, Conception et mise en œuvre d’un programme d’essais biologiques, Rapport du groupe de travail de la CCSN sur la dosimétrie interne, RSP-0182A.
- Agence internationale de l’énergie atomique, Évaluation de l’exposition professionnelle due à l’incorporation de radionucléides, Guide de sûreté no RS-G-1.2, 1999.
- Commission canadienne de sûreté nucléaire, Protocoles d’intervention pour les essais biologiques en cas d’incorporation anormale de radionucléides, Guide d’application de la réglementation G-147, 2003(b).
- Commission internationale de protection radiologique, Human Respiratory Tract Model for Radiological Protection, Publication 66, Vol. 24, nos 1 à 3, Pergamon Press, 1994.
- Commission internationale de protection radiologique, Individual Monitoring for Internal Exposure of Workers, Replacement of ICRP Publication 54, Publication 78, Pergamon Press, 1997.
- Health Physics Society, American National Standard–Performance Criteria for Radiobioassay, HPS N13.30-1996.
- Commission canadienne de sûreté nucléaire, Uranium Intake–Dose Estimation Methods, Rapport du Groupe de travail sur la dosimétrie interne de la CCSN, RPS-0165, 2003(c).
- Santé et Bien-être social Canada, Bioassay Guideline 2—Guidelines for Tritium Bioassay, Rapport du Groupe fédéral-provincial sur les critères relatifs aux essais biologiques et à la surveillance in vivo, Direction de l’hygiène du milieu, 83-EHD-87, 1983.
- Santé et Bien-être social Canada, Bioassay Guideline 4—Guidelines for Uranium Bioassay, 88-EHD-139, 1987.
- Commission internationale de protection radiologique, Dose Coefficients for Intakes of Radionuclides by Workers, Publication 68, Vol. 24, no 4, Pergamon Press, 1995.
- Leggett, R.W., Reliability of the ICRP’s Systemic Biokinetic Models, Radiation Protection Dosimetry, Vol. 79, 1998.
- Commission canadienne de sûreté nucléaire, Normes techniques et d’assurance de la qualité des services de dosimétrie au Canada, S-106 rév 1, 2006.
- Commission internationale de protection radiologique, Basic Anatomical and Physiological Data for Use in Radiological Protection: Reference Values, Publication 89, 2002.
- Commission internationale de protection radiologique, Recommandation 1990 de la Commission internationale de protection radiologique, Vol. 21, nos 1 à 3, Publication 60, 1991.
- Hickey, E.E., Stoetzel, G.A., McGuire, S.A., Strom, D.J., Cicotte, G.R., Wiblin, C.M., Air Sampling in the Workplace, NUREG-1400, 1993.
- Brodsky, A., Resuspension Factors and Probabilities of Intake of Material in Process (or is 10-6 a magic number in health physics?) , Health Physics, Vol. 39, no 6, pp. 992-1000, 1980.
- Knoll, G.F., Radiation Detection and Measurement, John Wiley & Sons, 2000.
RENSEIGNEMENTS ADDITIONNELS
Les documents suivants contiennent des renseignements additionnels qui pourraient présenter de l’intérêt pour les personnes participant à la conception et à la mise en œuvre d’un programme d’essai biologique :
- Commission canadienne de sûreté nucléaire, Contrôle et enregistrement des doses de rayonnement aux personnes, Guide d’application de la réglementation G-91, 2003(a).
- Santé et Bien-être social Canada, Bioassay Guideline 1–General Guidelines for Bioassay Programs, 81-EHD-56, 1980.
- Leggett, R.W., Predicting the Retention of Cs in Individuals, Health Physics, Vol. 50, pp. 747-759, 1986.
- Strom, D.J., Programmes for Assessment of Dose from Intakes of Radioactive Materials, Internal Radiation Dosimetry, Health Physics 1994 Summer School, pp. 543-570, 1994.
- Commission internationale de protection radiologique, Rapport du Groupe de travail sur l’homme de référence, Publication 23, 1975.
ANNEXE A
CHOIX DES PARTICIPANTS À UN PROGRAMME D’ESSAIS BIOLOGIQUES COURANTS BASÉ SUR
L’ACTIVITÉ MANIPULÉE
L’orientation sur le choix des participants à un programme d’essai biologique courant basé sur l’activité manipulée ou sur l’activité associée à des procédés est fournie dans diverses références [2], [4], [17]. Les valeurs indiquées au tableau 1 ont été principalement basées sur la méthode présentée dans le document American National Standard–Design of Internal Dosimetry Programs, Health Physics Society; toutefois, des valeurs semblables peuvent être obtenues dans d’autres références.
A.1 Fraction d’incorporation potentielle (FIP)
La fraction d’incorporation potentielle (FIP) est définie comme suit :
FIP = 10-6 × R × C × D × O × S
où :
|
10-6 |
= |
facteur de Brodsky [18] |
|
R |
= |
facteur de rejet |
|
C |
= |
facteur de confinement |
|
D |
= |
facteur de dispersabilité |
|
O |
= |
facteur d’occupation des locaux |
|
S |
= |
facteur relatif aux matières sous forme spéciale |
A.2 Facteur de rejet (R)
Les valeurs recommandées pour le facteur de rejet (R) sont :
|
Gaz, liquides fortement volatils |
1,0 |
|
Poudres non volatiles, liquides légèrement volatils |
0,1 |
|
Liquides, contamination générale, sur une vaste étendue |
0,01 |
|
Solides, contamination ponctuelle, matières contenues dans des particules de grande taille; par exemple, résines |
0,001 |
|
Matières encapsulées |
0 |
A.3 Facteur de confinement (C)
Les valeurs recommandées pour le facteur de confinement (C) sont :
|
Boîte à gants ou cellule chaude |
0,01 |
|
Hotte améliorée (enceinte fermée, avec ouvertures pour les bras) |
0,1 |
|
Hotte |
1,0 |
|
Matières contaminées contenues dans des sacs, ou enveloppées, matières contenues dans des sacs et placées dans des boîtes de bois ou de carton, serres |
10 |
|
Table de travail, contamination de surface dans une salle où la ventilation est normale |
100 |
A.4 Facteur de dispersabilité (D)
Les valeurs recommandées pour le facteur de dispersabilité (D) sont :
|
Mesures qui accroissent l’énergie des matières (chauffage, coupe, meulage, écrasement, soudage, mise sous pression, réactions exothermiques) |
10 |
|
Autres mesures (qui ne favorisent pas la dispersabilité) |
1 |
A.5 Facteur d’occupation des locaux (O)
Les valeurs recommandées pour le facteur d’occupation des locaux (O) sont :
|
Utilisation annuelle ou unique |
1 |
|
Utilisation mensuelle ou à quelques reprises durant l’année |
10 |
|
Utilisation hebdomadaire, une dizaine de fois durant l’année, ou des dizaines de jours lors d’un projet ponctuel |
50 |
|
Utilisation quotidienne essentiellement |
250 |
A.6 Facteur relatif aux matières sous forme spéciale (S)
Les valeurs recommandées pour le facteur relatif aux matières sous forme spéciale (S) sont :
|
Précurseurs de l’ADN (sauf 32P, 35S, ou 131I) |
10 |
|
Autres matières |
1 |
A.7 Valeurs du tableau 1
Les valeurs du tableau 1 ont été dérivées des paramètres suivants :
|
Gaz, liquides volatils et poudres |
R = 1 (gaz, liquides fortement volatils) |
|
Liquides et solides non volatils |
R = 0,01 (liquides, contamination d’une vaste étendue) |
ANNEXE B
EXEMPLES
B.1 Exemple 1 : Détermination de la participation à un programme d’essais biologiques
Un travailleur manipule en moyenne :
A) 1 × 106 Bq de 125I, trois fois par semaine, sous une hotte (en supposant que l’ingestion est la voie d’incorporation la plus probable);
B) 1 × 107 Bq de 3H (sous forme d’eau tritiée), presque quotidiennement, sous une hotte (en supposant qu’il y a ingestion);
C) 0,6 × 106 Bq de 131I, quatre fois par année, sur une table de travail (en supposant qu’il y a inhalation).
Toutes les matières radioactives se présentent sous une forme relativement volatile.
Les paramètres suivants doivent être déterminés :
- l’incorporation totale par année;
- le coefficient de conversion de dose (cet exemple utilise un coefficient de conversion de dose de e(50), selon la publication 68 de la CIPR [12]);
- la limite annuelle d’incorporation (LAI);
- la fraction d’incorporation potentielle (FIP) – (voir annexe A);
- les coefficients rj, où j = A, B, et C (correspondant aux trois incorporations de radionucléides définies ci-dessus);
- la somme des coefficients Rj, où Rj =rA + rB + rC.
Le tableau B1 montre des exemples de calcul étape par étape, dans le but de déterminer les valeurs de rj et de Rj.
Dans le cas qui nous occupe, les résultats des calculs à l’aide du tableau B1 sont :
- Rj < 1, par conséquent (et conformément à la section 4.2), le travailleur n’est pas obligé de faire l’objet d’une surveillance relative à des essais biologiques.
- Cependant, rA = 0,38 > 0,3, ce qui indique qu’il serait prudent d’effectuer des contrôles du 125I chez le travailleur.
Tableau B1 : Évaluation des coefficients rj et du coefficient de somme Rj.
|
125I (ingestion) |
3H (ingestion) |
131I (inhalation) |
|
|
Incorporation |
1 MBq par séance |
10 MBq par séance |
0,6 MBq par séance |
|
Incorporation totale par année |
106 × (3 × 52) |
107 × (5 × 52) |
0,6 × 106 × 4 |
|
Coefficient de conversion de dose e(50) |
1,5 × 10-8 Sv/Bq |
1,8 × 10-11 Sv/Bq |
2,0 × 10-8 Sv/Bq |
|
Limite annuelle d’incorporation (LAI), où :
|
1,3 MBq/année |
1,1 GBq/année |
1,0 MBq/année |
|
Fraction d’incorporation potentielle (FIP) |
Facteur d’occupation des locaux Facteur de confinement = 1 FIP = 1,56 × 10-4 |
Facteur d’occupation des locaux Facteur de confinement = 1 FIP = 2,5 × 10-4 |
Facteur d’occupation des locaux Facteur de confinement = 100 FIP = 4 × 10-4 |
|
Ratios rj, où :
|
= 0,38 |
= 0,01 |
= 0,02 |
|
Somme des ratios, rj |
|
||
B.2 Exemple 2 : Détermination de l’erreur de comptage (incertitude)
Les étapes à suivre pour calculer l’erreur associée au système de détection (statistique de comptage), ainsi qu’une démonstration du calcul de l’erreur de comptage à partir d’un résultat unique d’essai biologique sont illustrées ci-après :
(a) Résultats d’une mesure directe :
|
Comptage de l’échantillon : |
25 077 (par litre d’urine) |
|
Temps de comptage de l’échantillon : |
10 minutes |
|
Comptage du rayonnement de fond : |
4 300 (par litre d’urine) |
|
Temps de comptage du rayonnement de fond : |
20 minutes |
À la lumière de ces données, les taux de comptage sont calculés comme suit :
Taux de comptage de l’échantillon
= (comptage de l’échantillon) / (temps de comptage de l’échantillon)
= 25 077/10 min
= 2 508 coups par minute (cpm)
De même, le taux de comptage du rayonnement de fond est calculé comme suit :
Taux de comptage du rayonnement de fond
= (comptage du rayonnement de fond) / (temps de comptage du rayonnement
de fond)
= 4 300/20 min
= 215 cpm
(b) Taux de comptage net :
Le taux de comptage net est soustrait du taux de comptage de l’échantillon afin d’obtenir le taux de comptage net :
2 508 – 215 = 2 293 cpm
(c) Estimation de l’erreur de comptage : [19]
L’erreur de comptage (pour l’intervalle de confiance de 95 % basé seulement sur les statistiques de comptage) est donc calculée comme suit :
Erreur de comptage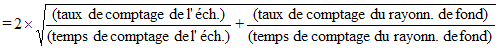
![]()
![]()
= 32 cpm
Ainsi, le taux de comptage de l’échantillon est de 2 293 ± 32 cpm. L’erreur statistique de 32 cpm représente l’erreur relative de (32 cpm) / (2 293 cpm) = 1,4 %.
(d) Résultat des mesures et de l’analyse :
Si l’efficacité du détecteur pour le 137Cs est de 10 %, le nombre de désintégrations par minute (dpm) est donné par :
(taux de comptage net) / (efficacité) = 2 293/0,10 = 22 930 dpm
Pour exprimer ce résultat en désintégrations par seconde, ou en becquerels (Bq), il suffit de diviser par 60, et nous obtenons 382 Bq. L’erreur relative de 1,4 % est reportée dans l’équation suivante :
382 Bq × 1,4 % = 5 Bq
Le résultat obtenu pour l’échantillon de l’essai biologique, incluant l’erreur statistique seulement, est donc donné par :
382 ± 5 Bq/L, ou (382 ± 1,5 Bq/L × 1,4 L/jour) = 535 ± 7 Bq/jour
(e) Conclusion
Dans cet exemple, nous avons tenu compte seulement d’une incertitude, soit la statistique de comptage. D’autres facteurs, comme la géométrie du comptage, peuvent accroître l’incertitude. La géométrie du comptage dépend dans une large mesure des radionucléides en cause.
B.3 Exemple 3 : Détermination de la fréquence de surveillance des incorporations de 137Cs
Le tableau 2 de la section 5.1 montre que le comptage du corps entier et l’analyse d’urine (comptage gamma) sont des méthodes appropriées pour détecter le 137Cs. La période de surveillance pour le comptage du corps entier est examinée en premier lieu.
Les activités dérivées (AD) pour le 137Cs dans les essais biologiques in vivo suite à une incorporation par inhalation sont représentées graphiquement en fonction de différentes périodes de surveillance, dans le graphique de la figure B1. La limite de détection a été ajoutée au graphique. Cette figure montre que 1 AD peut être détectée sur un grand éventail de périodes de surveillance. Une période de plus d’un an pourrait ainsi constituer un intervalle raisonnable entre les épisodes de surveillance des employés. D’autres considérations, décrites à la section 5.2, pourraient également influer sur le choix final de la période de surveillance.
Figure B1: Inhalation aiguë de 137Cs de type F – Activité
associée
à 1 mSv en fonction du temps
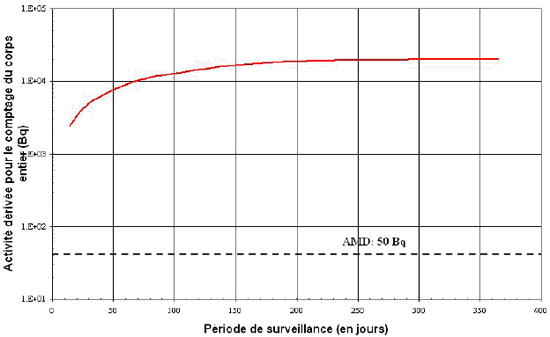
Il existe une autre méthode que le comptage du corps entier pour détecter le 137Cs, soit l’analyse in vitro. Ici encore, l’AD est comparée à la quantité minimale détectable (QMD) pour plusieurs fréquences de surveillance. La figure B2 montre que la limite de détection de 1 Bq/L [7] ne dépasse pas l’AD, entre 7 et 365 jours. Il convient également de noter que d’autres facteurs, décrits à la section 5.2, sont utiles pour choisir une fréquence de surveillance appropriée.
Figure B2: Activité dérivée pour l’excrétion urinaire, en cas
d’inhalation
aiguë de 137Cs de type F
B.4 Exemple 4 : Détermination de la fréquence de surveillance pour les incorporations de 131I
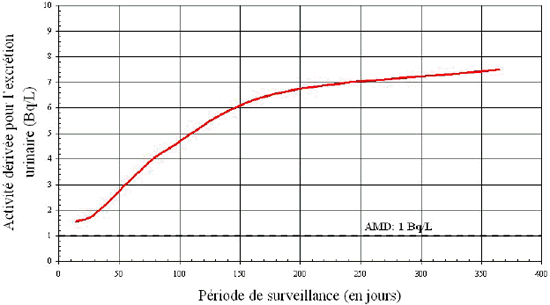
Une QMD de 100 Bq pour la surveillance thyroïdienne visant à détecter le 131I a été proposée [7]. Comme dans l’exemple précédent, l’AD est représentée graphiquement en fonction de différentes périodes de surveillance, allant de 2 à 180 jours. Le résultat est illustré à la figure B3.
D’après le graphique, il est clair que si la période de surveillance est inférieure à quatre (4) jours, ou supérieure à 65 jours, l’activité du 131I dans la thyroïde est inférieure à la QMD et que, pour cette raison, elle n’est pas détectée. Dans ce cas, une période de 14 à 30 jours constituerait un intervalle raisonnable entre les épisodes de surveillance.
Figure B3: 131I dans la thyroïde (inhalation aiguë de vapeur) –
Activité
dérivée en fonction du temps
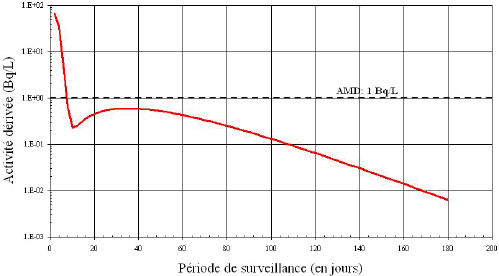
Bien que le 131I puisse être détecté grâce aux mesures in vitro, la figure B4 laisse supposer qu’après cinq (5) jours, la quantité de 131I excrétée est inférieure à la QMD de 1 Bq/L [7]. En outre, le taux d’excrétion de l’iode radioactif varie d’une personne à une autre et dépend de plusieurs facteurs, y compris la diète, l’âge et la prise de médicaments. Les écarts dans le taux d’excrétion entre les individus peut être important et, par conséquent, une période de surveillance de cinq (5) jours ne permet pas toujours de détecter 1 AD. Dans ce cas, l’analyse d’urine n’est pas recommandée à titre de méthode de surveillance courante pour évaluer les incorporations de 131I.
Figure B4: Activité dérivée pour l’excrétion urinaire du
131I
suite à une inhalation aiguë de vapeur
B.5 Exemple 5 : Niveaux d’enquête dérivés pour l’inhalation de 137Cs
Les niveaux d’enquête dérivés (NED) pour l’activité dans le corps entier et l’excrétion urinaire, en cas d’inhalation 137Cs de type F, sont calculés à l’aide des valeurs de m(T/2) tirées de la publication 78 de la CIPR (Commission internationale de protection radiologique), intitulée : Individual Monitoring for Internal Exposure of Workers, Replacement of ICRP Publication 54 [7]. Pour ce qui concerne la rétention dans le corps entier, sur une période de surveillance courante de 14 jours, les paramètres sont les suivants :
Période de surveillance : |
T = 14 jours |
Rétention dans le corps entier à T/2 : |
m(7 jours) = 0,42 |
LAI |
= 3E+06 Bq [12] |
NECT (T=14 jours) = 0,3 LAI (
![]() ) m
(T/2)
) m
(T/2)
= 0,3 (3E+06 Bq) (![]() ) (0,42)
) (0,42)
= 1,4 E+04 Bq
Les valeurs du NE pour le corps entier et pour l’excrétion urinaire, dans le cas des périodes de surveillance courante de 14 à 180 jours, sont illustrées au tableau B2. Les valeurs s’appliquent à l’inhalation du 137Cs de type F.
Tableau B2 : Niveaux d’enquête dérivés pour la surveillance courante du 137Cs
|
Intervalle de surveillance |
NE : Activité dans le corps entier |
NE : Excrétion urinaire quotidienne (Bq/jour) |
NE : Excrétion urinaire |
14 |
1,4 × 104 |
1,3 × 102 |
9,1 × 101 |
30 |
2,9 × 104 |
1,6 × 102 |
1,1 × 102 |
60 |
5,4 × 104 |
2,7 × 102 |
1,9 × 102 |
90 |
7,3 × 104 |
3,7 × 102 |
2,6 × 102 |
180 |
1,1 × 105 |
5,5 × 102 |
3,9 × 102 |
Détails de la page
- Date de modification :